AG Translationale Neuroonkologie
Unser Translationales Forschungsteam arbeitet an der Entwicklung und Umsetzung neuartiger Therapieverfahren zur Behandlung von Gliomen. Dabei verfolgen wir drei Strategien:
- Aufklärung und ein besseres Verständnis des Tumormikromillieus mit Fokus auf neurodegenerative und immunologische Prozesse.
- Aufklärung der metabolischen Achillesferse von Tumoren und der Einfluss der 'Fittness' von Patienten bei Gliomen.
- Neue intra-operative bildgebungsgestütze Verfahren wie DiVA und vDiVA zur suprakompletten Tumorchirurgie.
1. Das Tumormikromillieu
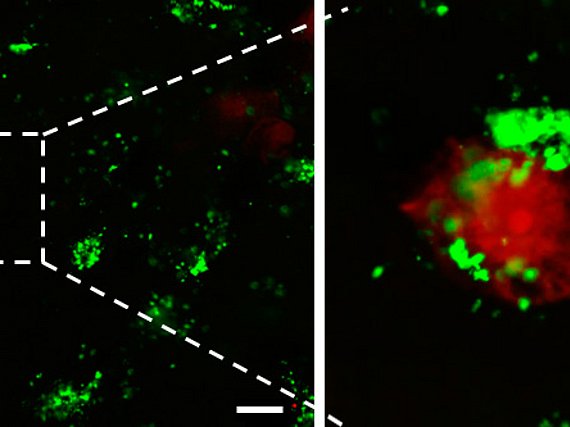
Gliome sind die bösartigsten Tumorerkrankungen für die es bisher keinen heilenden therapeutischen Ansatz gibt. Auch sind bisher die ursächlichen Faktoren der meisten Hirntumoren weitgehend unbekannt. Auf der anderen Seite hat es in jüngerer Zeit erhebliche Fortschritte im Verständnis der Interaktion von Tumoren im Gehirn gegeben. So besteht mittlerweile Konsens darüber, dass Gliome aktiv Hirngewebe durch die Bildung eines toxischen Mikromillieus zerstören und damit auch als eine neurodegenerative Erkrankung betrachtet werden können (Savaskan et al., 2015). Dies hat direkt Konsequenzen für therapeutische Strategien. Die erfolgreiche Translation neuer Erkenntnisse über neurotoxische Mechanismen in Therapiestrategien ist somit ein dringliches Ziel in unserer Klinik.
Unser Translationales Neuroonkologieteam beschäftigt sich weiterhin mit den Immunprozessen, die direkt von hirneigenen Tumoren zu ihren eigenen Vorteil gesteuert und mißbraucht werden. So haben wir in Gliomen Botenstoffe identifiziert, die direkt Einfluss auf die Immunzellen des Gehirns nehmen und diese quasi auschalten.
Wir sind nun im Prozess, die folgenden Fragen im Detail zu erforschen:
- Welche Rolle spielen Tumormetaboliten bei der Zerstörung von Nervenzellen?
- Können epigenetische Modulatoren Tumoren neu ‚primen‘ und damit zähmen?
- Wie können immunkompetente Zellen wie die Mikroglia reprogrammiert werden, um Gliome erfolgreich einzudämmen?
Zur Untersuchung dieser Forschungsansätze steht uns die komplette Bandbreite der molekularbiologischer und zellbiologischer Techniken zur Verfügung.
2. Metabolisches Profil von Tumoren und Patienten
Trotz kombinierter multimodaler Therapien zeigen maligne Gliome ein schlechtes Ansprechen auf die Standardbehandlungen.
Verschiedene klinische und molekulare Faktoren wie Alter, Karnofsky Performancescore sowie genetische und epigenetische Prädispositionen wurden bei Patienten mit höhergradigen Gliomen identifiziert, die eine prädiktive Aussage im Hinblick auf das post-operative Outcome erlauben. Bei der ‚first line‘ Therapie von höhergradigen Gliomen, der chirurgischen Resektion, beschränken sich die Variablen bisher lediglich auf das Ausmaß der Tumorreduktion. Wir arbeiten in diesem Forschungsansatz nun an Parametern der physischen Fittness von Patienten. In Zusammenarbeit mit Prof. Yurdagül Zopf gegen wir dabei der Frage nach, in wieweit Ausdauer und Muskelindex Einfluss auf die Tumorerkrankung nimmt. Parallel untersuchen wir zudem den Stoffwechselstatus von Tumoren.
Ziel dieser Untersuchungen ist hierbei, klinisch wichtige Konstanten zu ermitteln, die es erlauben, Patienten mit einer Gliomerkrankung optimal auf die chirurgische und medikamentöse Therapie einzustellen und sie damit insgesamt ‚fitter‘ und widerstandsfähiger zu halten.
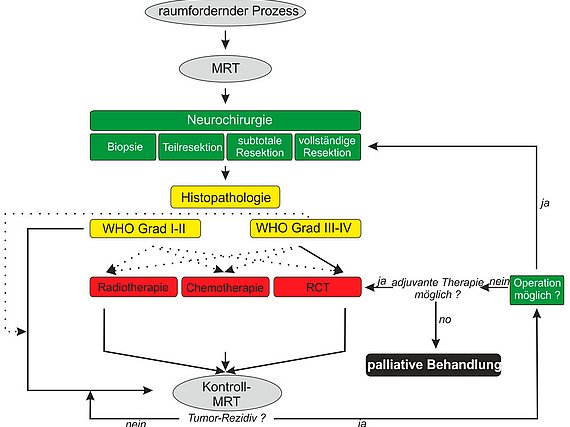
3. DiVA Verfahren und die Entwicklung von intra-operativen Bildgebungstechniken zur präzisen Tumorchirurgie
Aktuelle Studien weisen das Ausmaß der Tumorreduktion (Extent of resection) als entscheidend für das Anschlagen der nachgeordneten Radio- und Chemotherapie.
Ein entscheidender Faktor für das Überleben des Patienten mit einem malignen Gliom stellt die möglichst suprakomplette also vollständige Resektion des Tumors dar. Werden bei schlechter Visualisierung Tumormassen in situ belassen, so ist die Zeit bis zum Tumorrezidiv deutlich kürzer, was mit einer Verkürzung der Lebenszeit und einer schlechteren Lebensqualität vergesellschaftet ist (Eyüpoglu et al., 2013).
Eine makroskopisch komplette Resektion (entspricht der vollständigen Entfernung des kontrastmittelaufnehmenden Areals im MRT) wird aber bei ausschließlicher Anwendung eines konventionellen Operationsmikroskops nur in etwa 30% der Fälle erreicht. Die Schwierigkeit hierbei liegt darin, intraoperativ vitales Tumorgewebe von normalem, also gesundem Hirngewebe zu unterscheiden. Das Problem stellt somit die eindeutige Identifikation des hirneigenen Tumors an den Tumorgrenzen dar.
Durch die Anwendung des DiVA Verfahrens gelingt es, die Rate der makroskopisch kompletten Resektionen auf 100 % zu steigern (Eyüpoglu et al., 2012). Dazu wird erst unter Zuhilfenahme der 5-ALA Methode der Tumor reseziert und anschließend das Ergebnis mittels intraoperativem MRT verifiziert. Durch die Anwendung von zwei Visualisierungsverfahren (DIVA: dual intraoperative visualization approach) wird eine verbesserte Darstellung der Tumorgrenzen erreicht. Durch die Entwicklung dieser beiden Verfahren, d.h. der biochemischen 5-ALA Methode und dem intraoperativen MRT, ist in der chirurgischen Neuroonkologie ein deutlicher Fortschritt zur schonenden und möglichst kompletten Tumorresektion gelungen.
Weiterhin arbeiten wir eng mit Experten der Neuronavigation und Spetrometrie zusammen, um durch die räumliche Verteilung von Biomarkern (wie N-Acetyl-Aspartat, Cholin und Kreatin) den Tumormetabolismus zu verfolgen und damit die Tumorgrenzen aufzuspüren. Die Lage des Tumors eine entscheidende Einflussgrösse. Hierzu haben wir eine zuverlässige prä-operative funktionelle Klassifikation entwickelt, die die Beurteilung des post-operativen Verlaufs und des Gesamtausgangs der Erkrankung erlaubt.
Ausgewählte Publikationen:
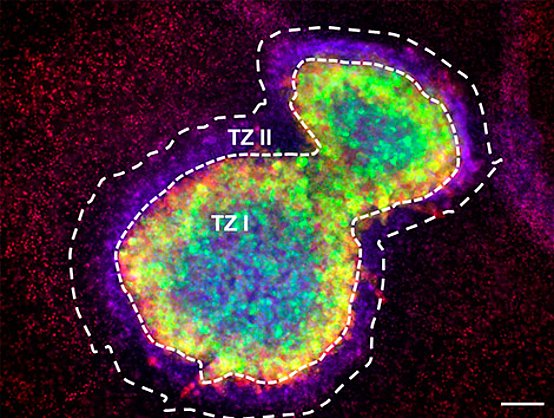
Eyüpoglu IY, Hore N, Buslei R, Fan Z, Merkel A, Buchfelder M, Savaskan NE. Intraoperative vascular DIVA (vDiVA) surgery reveals angiogenic hotspots in tumor zones of malignant gliomas. Sci Rep. 2015 Jan 22;5:7958. doi: 10.1038/srep07958.
Eyüpoglu IY, Buchfelder M, Savaskan NE. Surgical resection of malignant gliomas-role in optimizing patient outcome. Nat Rev Neurol. 2013; 9(3):141-51.
Savaskan NE, Seufert S, Hauke J, Tränkle C, Eyupoglu IY and Hahnen E. Dissection of Mitogenic and Neurodegenerative Actions of Cystine and Glutamate in Malignant Gliomas. Oncogene 2011, 30(1):43-53.
Fan Z, Sehm T, Rauh M, Buchfelder M, Eyüpoglu IY, Savaskan NE. Dexamethasone alleviates tumor-associated brain damage and angiogenesis. PONE 2014, 9(4):e93264.
Friedlein K, Bozhkov Y, Hore N, Merkel A, Sommer B, Brandner S, Buchfelder M, Savaskan NE*, Eyüpoglu IY. A new functional classification system (FGA/B) with prognostic value for glioma patients. Sci Rep. 2015 Jul 21;5:12373. doi: 10.1038/srep12373.
Savaskan NE, Hacke A, Hahnen E, Engelhorn T, Doerfler A, Ganslandt C, Nimsky C, Buchfelder M, and Eyupoglu IY. siRNA mediated xCT silencing inhibits neurodegeneration and alleviates brain edema in malignant gliomas.
Nature Medicine 2008, 14 (6): 629-632.