AG physio-metabolische Bildgebung und MR-Physik
Ansprechpartner: Prof. Dr. techn. Andreas Stadlbauer
Die Arbeitsgruppe physio-metabolische Bildgebung und MR-Physik beschäftigt sich mit der Entwicklung, Evaluierung und Implementierung innovativer Bildgebungsverfahren der Magnetresonanztomographie (MRT, auch Kernspin) sowie neuartiger Softwarekonzepte und –Methoden zur Bildverarbeitung. Ziel ist es einerseits, die prä- und intraoperative Planung neurochirurgischer Eingriffe zu verbessern, und andererseits, das postoperative Monitoring zu personalisieren. Auf Basis der physikalischen Prinzipien der MR-Bildgebung werden medizinische Bilddaten mit physio-metabolische Modellen ausgewertet. Dadurch ist es möglich einen genaueren Einblick in die intratumorale Heterogenität der Pathophysiologie von Hirntumoren zu gewinnen. Die physio-metabolische Bildgebung leistet damit einen wesentlichen Beitrag, die komplexen pathophysiologischen Vorgänge in Hirntumoren während und nach therapeutischer Maßnahmen sichtbarer und verständlicher zu machen.
MRT-basierte, nichtinvasive Darstellung der Mikrovaskulatur von Hirntumoren
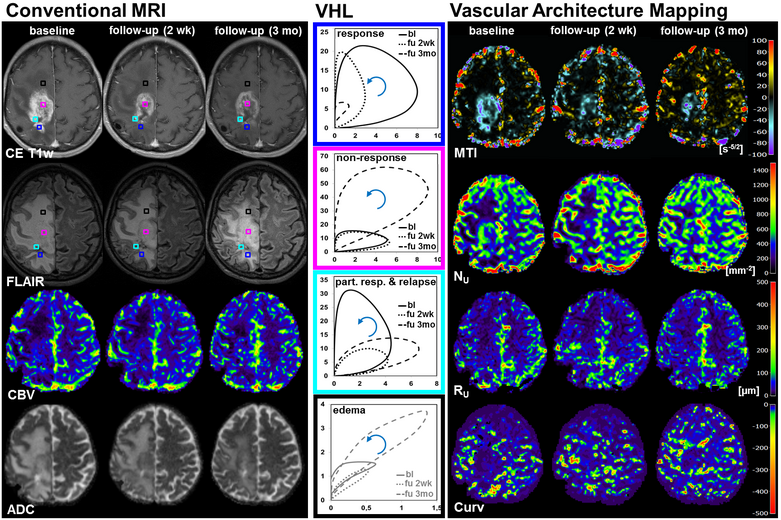
Blutgefäße spielen eine entscheidende Rolle im Entwicklungsverlauf bösartiger Tumore. Im frühen Stadium der Tumorentwicklung wachsen die meisten Läsionen avaskulär bis ein Gleichgewicht zwischen Proliferation und Apoptose erreicht ist, danach setzt meist Neoangiogenese ein. Der Grad der Vaskularisierung ist oft mit Tumoraggressivität sowie schlechter Prognose und Outcome korreliert. Eine Beurteilung der Architektur des Tumorgefäßbetts ist daher von hoher Relevanz für die klinische Beurteilung und der Therapieplanung von Hirntumoren.
In einem wissenschaftlichen Projekt unter Leitung der Neurochirurgischen Klinik, das mit finanzieller Unterstützung der Deutschen Forschungsgemeinschaft initiiert und internationaler Beteiligung zur Zeit noch läuft, konnten neue Strategien der MRT-Bildgebung und der Bildverarbeitung zur Darstellung der Neovaskularisation von Hirntumoren entwickelt werden. Wir implementierten neuartige Bewertungsstrategien von MR-Perfusionsdaten und führten neue MRI-Biomarker ein, die detailliertere Einblicke in die Komplexität und Heterogenität vaskulärer Veränderungen bei Hirntumoren liefern. Nachuntersuchungen bei Patienten mit rezidivierenden Glioblastomen während einer antiangiogenen Monotherapie (Bevacizumab) zeigten, dass die frühe Reaktion (nach einem Monat) auf Bevacizumab durch die Reduktion der kleineren Mikrovaskulatur (etwa 10 μm) dominiert wird. In der 3-Monats-Kontrolle zeigte sich bei den Tumoren zusätzlich eine Reduktion der größeren Mikrovaskulatur (> 20 μm).
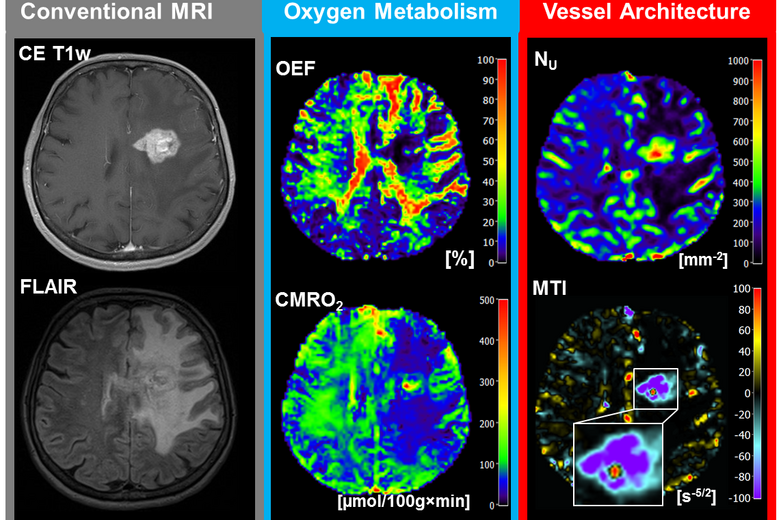
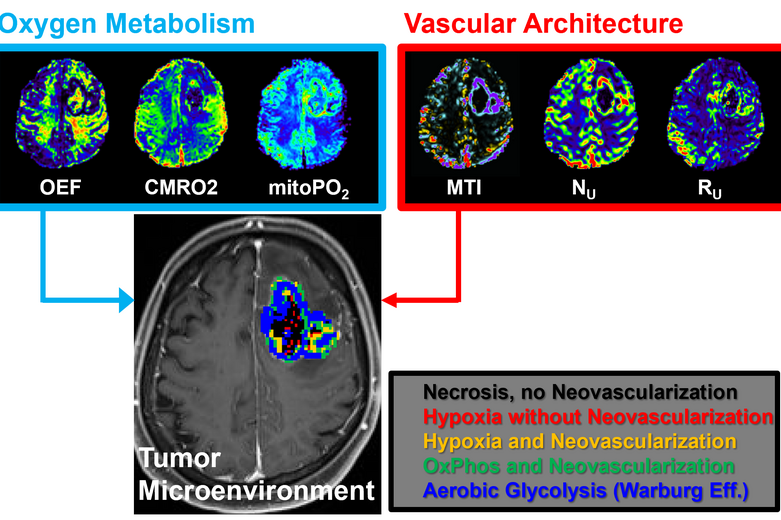
Hypoxie (Mangelversorgung an Sauerstoff) ist ein bekannter Auslöser der Neovaskularisation. Es besteht eine starke Beziehung zwischen der Neubildung von Tumorvaskulatur, der Sauerstoff- und Nährstoffversorgung und den Pfaden des Energiestoffwechsels (Warburg Effekt). In einem wissenschaftlichen Projekt zur Korrelation von Sauerstoffmetabolismus und Neovaskularisierung konnten wir zeigen, dass unsere eingeführten Biomarker verglichen mit anderen bildgebenden Biomarkern am besten für die Differenzierung des IDH1-Genmutationsstatus bei anaplastischen Gliomen geeignet ist.
Darstellung der Tumor-Mikroumgebung von Hirntumoren
Darauf aufbauend fusionierten wir die MRI-Biomarker-Informationen für den Sauerstoffmetabolismus und die Neovaskularisation mithilfe einer automatischen Klassifizierungsstrategie und ermöglichen damit die nichtinvasive Lokalisierung hypoxischer und vaskulärer Nischen innerhalb der heterogen strukturierten Tumor-Mikroumgebung (tumor micro-environment, TME). Unser Ansatz, den wir als TME-Mapping bezeichnen, offenbarte zwei unterschiedliche metabolische Phänotypen für Glioblastome. In Rezidiven von Gliomen konnten wir so feststellen, dass diese signifikant hypoxischer sind als noch unbehandelte Tumoren. Kürzlich haben wir gezeigt, dass hypoxische Nischen für Therapieversagen und die Einleitung von Neovaskularisation verantwortlich sind.
KI-unterstützte Klassifizierung von Hirntumoren
Die diagnostischen Verbesserungen durch innovative Bildgebungsmethoden gehen mit einer zunehmenden Anzahl und Komplexität zusätzlicher Neurobildgebungsdaten einher. Für unseren physio-metabolischen Ansatz bedeutet dies, dass bei jeder MRT-Untersuchung eines Patienten zusätzlich zu den klinischen MRT-Daten sieben Biomarkerkarten erstellt werden. Eine zeitnahe Auswertung dieser komplexen Informationen durch einen Menschen ist im klinischen Alltag nicht möglich. Dadurch gehen wertvolle Informationen verloren. Methoden der künstlichen Intelligenz (KI) wie Deep Learning (DL) und traditionelles maschinelles Lernen (ML) bieten neue Möglichkeiten zur Unterstützung von Medizinern.
In drei aktuellen Studien haben wir hochdimensionale Radiomics-Merkmale aus den physio-metabolischen MRT-Daten mit traditionellen ML- und DL-Methoden kombiniert, um die Nützlichkeit und Wirksamkeit von KI für die präoperative Klassifizierung unbehandelter Hirntumore in einem klinischen Umfeld zu untersuchen. Wir nennen diesen Ansatz „Radiophysiomics“. Wir konnten nachweisen, dass die KI-basierte Radiophysiomics sowohl der menschlichen Beurteilung als auch der KI-basierten Klassifizierung von Hirntumoren mit konventionellen MRT-Daten überlegen war.
Von noch bedeutender klinischer Relevanz ist allerdings die KI-unterstützte Verbesserung der Diagnostik von Hirntumor-Rezidiven. Die Entwicklung eines KI-gestützten Behandlungsmonitors der nächsten Generation zur Ergebnisvorhersage auf der Grundlage serieller klinischer und physio-metabolischer Bildgebungsdaten ist das aktuelle Forschungsgebiet der AG physio-metabolische Bildgebung und MR-Physik.
Ausgewählte Publikationen:
- Machine Learning-Based Prediction of Glioma IDH Gene Mutation Status Using Physio-Metabolic MRI of Oxygen Metabolism and Neovascularization (A Bicenter Study). A. Stadlbauer, K. Nikolic, S. Oberndorfer, F. Marhold, T.M. Kinfe, A. Meyer-Bäse, D.A. Bistrian, O. Schnell, A. Doerfler. Cancers 2024,16:1102.
- Differentiation of Glioblastoma and Brain Metastases by MRI-Based Oxygen Metabolomic Radiomics and Deep Learning. A. Stadlbauer, G. Heinz, F. Marhold, A. Meyer-Bäse, O. Ganslandt, M. Buchfelder, S. Oberndorfer. Metabolites 2022, 12:1264
- Radiophysiomics: Brain Tumors Classification by Machine Learning and Physiological MRI Data. A. Stadlbauer, F. Marhold, S. Oberndorfer, G. Heinz, M. Zimmermann, M. Buchfelder, T.M. Kinfe, A. Meyer-Bäse. Cancers 2022, 14(10): art. no. 2363
- Tissue Hypoxia and Alterations in Microvascular Architecture Predict Glioblastoma Recurrence in Humans. A. Stadlbauer, T. M. Kinfe, M. Zimmermann, I. Eyüpoglu, M. Kitzwögerer, K. Podar, M. Buchfelder, G. Heinz, S. Oberndorfer, F. Marhold. Clin Cancer Res. 2021;27(6):1641-1649
- Physiologic MR Imaging of the Tumor Microenvironment Revealed Switching of Metabolic Phenotype upon Recurrence of Glioblastoma in Humans. A. Stadlbauer, S. Oberndorfer, M. Zimmermann, B. Renner, M. Buchfelder, G. Heinz, A. Doerfler, A. Kleindienst, K. Roessler. J Cereb Blood Flow Metab 2020; 40:528-538
- Predicting Glioblastoma Response to Bevacizumab through MRI Biomarkers of the Tumor Microenvironment. A. Stadlbauer, K. Roessler, M. Zimmermann, M. Buchfelder, A. Kleindienst, A. Doerfler, G. Heinz, S. Oberndorfer. Molecular Imaging and Biology 2019; 21:747-757
- Intratumoral heterogeneity of oxygen metabolism and neovascularization uncovers 2 survival-relevant subgroups of IDH1 wild-type glioblastoma. A. Stadlbauer, M. Zimmermann, A. Doerfler, S. Oberndorfer, M. Buchfelder, R. Coras, M. Kitzwögerer, K. Roessler. Neuro-Oncology 2018; 20:1536–1546.